Sodium-potassium ATPase (Hebrew)
From Proteopedia
Contents |
מבוא
משאבת נתרן אשלגן היא קומפלקס חלבוני המעוגן לקרום התא (ממברנה תאית) ומשמש להעברה פעילה של יוני נתרן ואשלגן אל מחוץ לתא ולתוכו.
פעילות המשאבה יוצרת גרדיאנט אלקטרוכימי (מפל ריכוזים ומתח חשמלי) של נתרן ואשלגן בין שני צידי הקרום, שהינו חיוני לתאי בעלי חיים (ממלכת Animalia). גרדיאנט זה מאפשר העברת חומרים דרך ממברנת התא ומספק את האנרגיה הדרושה כדי להעביר חומרים גם נגד כיוון מפל הריכוזים הטבעי שלהם.
בסרטון הבא ניתן למצוא הסבר קצר על העברה פעילה
(רלוונטי עד נקודת זמן 2:23).
משאבת נתרן-אשלגן היא החלבון שמאפשר לתאים של בעלי חיים, לשמר את מפל הריכוזים של יונים אלו ובנוסף פועלת ביעילות גבוהה.
כמו כן, הוכח כי משאבה זו משמשת גם כקולטן לסיגנלים סטרואידיים המעורבים בכיווץ הלב.
מפל הריכוזים שנוצר מפעילות המשאבה מספק אנרגיה למספר פעולות תאיות חשובות כגון: שליטה על פוטנציאל ממברנלי, שמירה על גודל תא, שמירה על הומיאוסטאזיס pH, קליטה של נוטריינטים, מים ועוד.
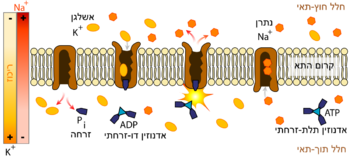
מנגנון השאיבה
המשאבה מעבירה שלושה יוני נתרן (+Na) ושני יוני אשלגן (+K) דרך ממברנת התא. ריכוז יוני הנתרן בתוך התא נמוך יחסית לריכוזו מחוץ לתא. ריכוז יוני האשלגן בתוך התא גבוה יחסית לריכוזו מחוץ לתא. המשאבה פועלת כנגד מפל הריכוזים של יונים אלו ולכן התהליך צורך אנרגיה, בצורת פירוק (דה-פוספורילציה) של מולקולת ATP, שהיא "מטבע האנרגיה" העיקרי של הגוף.
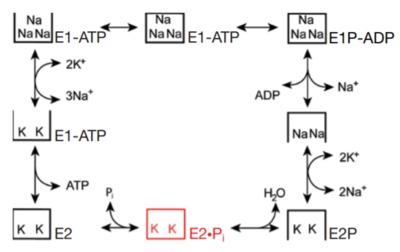
המשאבה פועלת באופן רציף ומחזורי. שלבי פעולתה מכונים מצבים (states, ביחיד state).
במצב E1 מולקולת ATP קשורה לאתר הקישור ואתרי קישור לנתרן פתוחים לצידה התוך-תאי (ציטוזולי) של המשאבה. במצב זה נקשרים לחלבון 3 יוני נתרן ומתרחש שינוי במבנה המרחבי (שינוי קונפורמציה) במשאבה.
שינוי הקונפורמציה מקרב את מולקולת ה-ATP לאתר הקטליטי במשאבה. ATP עוברת פירוק (דה-פוספורילציה) וקבוצת הזרחה (פוספט) נקשרת לחלבון בקשר עתיר-אנרגיה, תגובה זו נקראת גם זירחון החלבון.
קישור קבוצת הפוספט לחלבון גורם לשינוי קונפורמציה נוסף וסגירה של השער הציטוזולי של המשאבה. במצב זה שלושת יוני הנתרן כלואים באופן זמני בחלק חוצה-הממברנה של המשאבה.
ADP שנותר מפירוק מולקולת ה-ATP, משוחרר מהחלבון לציטוזול. מצב זה נקרא E1-P.
זהו מצב אנרגטי מאוד של החלבון ולכן החלבון עובר שינוי קונפורמציה מהיר למצב E2-P, אשר פותח את השער החוץ-תאי של המשאבה.
הזיקה (אפיניות) של יוני הנתרן לחלבון במצב זה הינה נמוכה יותר והם משתחררים לסביבה החוץ-תאית. שני יוני אשלגן מהסביבה החוץ-תאית נקשרים בזיקה גבוהה לאתרים בתוך החלבון.
כאשר יוני האשלגן קשורים לצד החוץ-תאי, מתרחש שינוי קונפורמציה שסוגר את השער החוץ-תאי וכולא את יוני האשלגן בתוך המשאבה. שינוי זה גורם גם לדה-פוספורילציה (שחרור קבוצת זרחה) של החלבון.
כאשר קבוצת הזרחה משוחררת מהחלבון, החלבון נמצא במצב E2 ואתר הקישור למולקולת ATP זמין.
כש-ATP נקשר לאתר בחלבון, החלבון חוזר למצב E1 - השער הציטוזולי נפתח ויוני האשלגן משתחררים לתוך התא.
האפיניות ליוני נתרן באתרי הקישור עולה ומחזור השאיבה ממשיך.
הסרטון הבא מציג את שינויי הקונפורמציות בפעילות המשאבה.
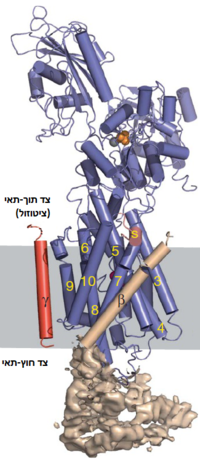
דגשים מבניים
| |||||||||||
מחלות
פעילות המשאבה יכולה להתקיים עם יחידת אלפא ויחידת בטא, אחת מכל סוג. ביונקים ישנם 4 איזופורמים של יחידת אלפא, המקודדים על ידי הגנים ATP1A1 עד ATP1A4 בהתאמה: איזופורם אלפא-1 מתבטא בעיקר במערכת העצבים המרכזית של בוגרים, איזופורם אלפא-2 מתבטא בעיקר באסטרוציטים, איזופורם אלפא-3 מתבטא בעיקר בנוירונים.
יוני נתרן ואשלגן הינם היונים המרכזיים המעורבים בהתקדמות פוטנציאל הממברנה במהלך הדה-פולריזציה של נוירון. לכן איזופורמים 1 עד 3 של תת-היחידה אלפא הם המועמדים העיקריים לשיחזור פוטנציאל ממברנלי בנוירונים לאחר הדה-פולריזציה ולשימור היכולת של תא הנוירון לעבור עירור נוירונאלי.
מחקר שביצעו Holm ושות' ב-2016 הציע שהאיזופורם אלפא-3 משתתף במיחזור הנוירוטרנסמיטורים, פעילות חשובה לתפקוד תקין של מערכת העצבים.
כבר ב-2007 Morth ושות' הציעו כי איזופורם אלפא-3 תומך בתהליכי ספיגה/קליטה-מחדש של נוירוטרנסמיטורים. תהליכים אלו נחוצים לפעילות מוחית תקינה, ולמעשה מוטציות אוטוזומליות דומיננטיות בגן ATP1A3 (המקודד לאיזופורם זה) נמצאו[1] כגורמות לשלוש מחלות נוירולוגיות:
Rapid Onset Dystonia Parkinsonism (RDP)
Alternating Hemiplegia of Childhood (AHC)
Cerebellar ataxia, areflexia, pes cavus, optic atrophy and sensorineural hearing loss (CAPOS)
הפניות
1) משאבת נתרן-אשלגן - מנוע מפלי ריכוזים, מאת ד"ר ארז גרטי, אתר מכון דוידסון. פורסם ב-30 ביולי, 2009[2].
2) Morth JP, Pedersen BP, Toustrup-Jensen MS, et al. Crystal structure of the sodium-potassium pump. Nature. 2007; 450(7172); pages 1043-1049. [3]
3) Holm, T. H., & Lykke-Hartmann, K. (2016). Insights into the Pathology of the α3 Na(+)/K(+)-ATPase Ion Pump in Neurological Disorders; Lessons from Animal Models. Frontiers in physiology, volume 7, article 209. [4]
4) Brashear A, Sweadner KJ, Cook JF, et al. ATP1A3-Related Neurologic Disorders. Updated 2018 Feb 22. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. University of Washington, Seattle; 1993-2020. [5]
5) Pilotelle-Bunner, A., Cornelius, F., Sebban, P., Kuchel, P. W., & Clarke, R. J. (2009). Mechanism of Mg2+ binding in the Na+,K+-ATPase. Biophysical journal, 96(9), pages 3753–3761. [6]