|
אנזים מתעתק במהופך (Reverse Transcriptase, להלן RT) הוא אנזים שמקורו בנגיפים, בעיקר נגיפים מקבוצת רטרווירוסים. הנגיף המפורסם ביותר הנושא את האנזים RT הוא נגיף ה-HIV הגורם לתסמונת הכשל החיסוני הנרכש (AIDS) בבני אדם. התאים המאכסנים העיקריים של הנגיף הם לימפוציטים מסוג T מסייעים (T Helpers).
אנזים זה מזרז שלוש פעולות ביוכימיות הבאות ברצף אחת אחרי השנייה. התוצאה של שלוש פעולות אלה היא העתקה של החומר הגנטי של הנגיף מ-RNA חד-גדילי ל-DNA דו-גדילי. שלוש הפעולות הן:
1. היקשרות למולקולת RNA חד-גדילית ובניית גדיל DNA משלים על גבי תבנית גדיל ה-RNA, לפי התאמה בין הנוקלאוטידים: A מול U ו-C מול G;
2. פירוק של מולקולת ה-RNA שנמצאת במבנה דו-גדילי עם גדיל DNA. כעת האנזים נותר קשור למולקולת DNA חד-גדילית בלבד;
3. בניית גדיל DNA משלים על גבי תבנית של מולקולת DNA חד-גדילי, לפי התאמה בין הנוקלאוטידים.
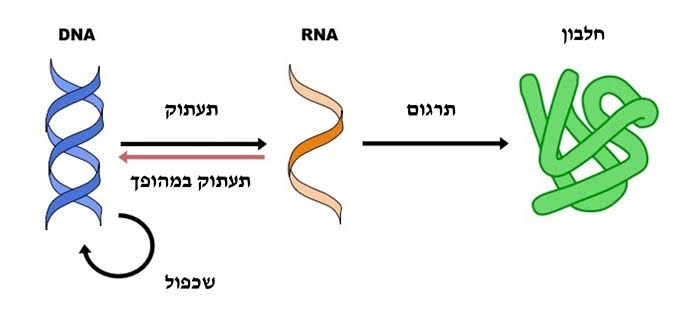
מולקולת ה-DNA הדו-גדילית יכולה להשתלב לתוך הגנום של התא המאכסן, ומשם לעבור תהליכים תאיים כמו
שכפול
ותעתוק.
האנזים התגלה בשנת 1970 על ידי הווארד טמין מאוניברסיטת ויסקונסין-מדיסון ברטרווירוס התוקף עכברים.
באותה שנה האנזים בודד באוניברסיטת MIT מרטרווירוס אחר התוקף תרנגולות, על ידי דיויד בולטימור. השניים קיבלו פרס נובל לרפואה על הישגיהם בשנת 1975.
הקהילה המדעית התקשתה תחילה לקבל את הרעיון של תעתוק במהופך שכן הוא חורג מהדוֹגמה המרכזית של הביולוגיה המולקולרית, לפיה קיים כיוון אחד של העברת מידע בתאים: DNA מתועתק למולקולת RNA, ומולקולת ה-RNA מתורגמת לחלבון.
 [1] [1]
אופן העברת המידע לפי הדוגמה המרכזית נצפה באורגניזמים שונים ובתנאים שונים, ולכן נתפס עד אז כבלעדי בעולם החי. אולם לאור ההוכחות שהציגו טמין ובולטימור, והעובדה שהוכחות אלה היו בלתי תלויות זו בזו ונצפו במקביל במקומות שונים בעולם, הקהילה המדעית הכירה בקיומו של תעתוק במהופך בעולם החי.
מבנה ותפקוד האנזים
האנזים RT מורכב משתי תת-יחידות השונות זו מזו, ולכן מסווג כ (הטרו = שונה, דימר = שתי תת-יחידות). אורכו 560 חומצות אמיניות בשרשרת A ו-440 חומצות אמיניות בשרשרת B.
באנזים RT אפשר למצוא שונים: כשליש מהחומצות האמיניות נמצאות במבנה שניוני של , וכרבע מהן נמצאות במבנה שניוני של . המבנים השניוניים האלה תורמים ל של האנזים כולו. מבנה מרחבי זה מאפשר קישור לגדיל (בירוק) המשמש סובסטרט ולגדילי ה- (בתכלת) הנוצרים לפיו.
הפעילות האנזימטית של RT מתבצעת כולה על ידי שרשרת A (שרשרת B אינה פעילה אנזימטית כלל, וככל הנראה תורמת לייצוב המבנה המרחבי של האנזים). בתוך שרשרת A ישנם חמישה אזורים מוגדרים. שניים מהאזורים משתתפים בפעילות האנזימטית של RT:
• (ח"א 117-86 וח"א 236-156, מוצגות ככדורים אדומים) – אזור זה נקרא כך בשל שלו: הוא נמצא בין אזור האצבעות ובין אזור האגודל (ר' בהמשך). בתוך אזור זה נמצא האתר הפעיל של האנזים RT, ובו מתבצעת בניית גדיל DNA, הן על בסיס גדיל RNA בפעולה האנזימטית הראשונה והן על בסיס DNA בשלב השלישי. בעמדה 110 ובעמדות 185-186 נמצאת הח"א חומצה אספרטית. (בכחול) קשורות בקשר יוני ליוני מגנזיום הטעונים במטען חשמלי 2+ (בוורוד) ותורמים לייצוב המבנה המרחבי של האתר הפעיל. כאשר פגעו בניסויים[2] בגן המקודד לאנזים RT וגרמו למוטציה בעמדות 110, 186-185, פעילות התעתוק-במהופך של האנזים שקודד מהגן הפגוע ירדה מאוד. בנוסף, הרצף בעמדות 235-227, המכונה (בכתום), חשוד כי הוא מעורב בייצוב מולקולת ה-DNA הנבנית ובקשירה של נוקלאוטיד נוסף אליה;
• (ח"א 427 עד סוף השרשרת, מוצגות ככדורים אדומים) – לאזור זה פעילות אנזימטית אחרת: באזור זה מתפרק גדיל ה-RNA לאחר התעתוק במהופך. גם באזור זה קשור יון מגנזיום חיובי בקשרים יוניים;
• אזור מוגדר נוסף בשרשרת A הוא (ח"א 426-319, מוצגות ככדורים אדומים) – באזור זה מתרחשת האינטראקציה בין שרשרת A (באדום) ושרשרת B (בוורוד). בתוך האזור נמצא רצף המכונה "מוטיב " בעמדות 414-398 (בכתום), ובו 17 חומצות אמיניות, שש מהן הן
טריפטופן
(החומצה האמינית הנדירה ביותר, בכחול). בניסוי[3] שנערך הוחלפה החומצה האמינית טריפטופן שבעמדה 401 באמצעות מוטציה בגן. כאשר הטריפטופן הוחלפה בחומצה האמינית
פנילאלאנין, הפעילות האנזימטית של RT כמעט ולא הושפעה. אולם כאשר טריפטופן הוחלפה בחומצה האמינית
לאוצין,
השרשרות A ו-B נפרדו והאנזים איבד את פעילותו;
• מוגדרים נוספים בשרשרת A הם האצבעות (חומצות אמיניות 85-1 וחומצות אמיניות 155-118, בכתום) והאגודל (ח"א 318-237, בוורוד). אזורים אלה מכונים כך בגלל הצורה המרחבית שלהם, והם נמצאים משני צדי אזור כף היד (באדום). כאשר מסתכלים על המבנה המרחבי של שלושת האזורים, הם נדמים לכף יד הלופתת את הסליל הכפול של חומצות גרעין שבמרכז האנזים.
מהימנות הפעילות האנזימטית
בעת פעולתו, האנזים RT מועד לטעויות. בניסוי[4] שנערך נמצא כי תדירות המוטציות במולקולת ה-DNA הנוצרת הוא 1 ל-4000-2000.
משמעות הדבר היא שמתרחשת מוטציה אחת כל כשלושת אלפים נוקלאוטידים המתרכבים למולקולת ה-DNA הנוצרת. קצב המוטציות הגבוה גורם לכך שהחומר התורשתי של הנגיף משתנה כמעט עם כל הדבקה. עקב כך, מוטציות שמתרחשות במהלך פעולתו של אנזים RT גורמות לשינוי החומר הגנטי של הנגיף. דבר זה מאפשר לנגיף "להתחמק" מן המערכת החיסונית של המאכסן ולפתח עמידות נגד תרופות אנטי-ויראליות, ולכן פיתוח תרופות נגד הנגיף נתקל בקשיים רבים.
שימושים בביולוגיה מולקולרית
האנזים RT משמש במעבדות רבות בעולם ליצירת מולקולות DNA מתבנית של מולקולות RNA באמצעות במספר שיטות. אחת מהן היא שיטה בשם
RT-PCR . התוצר הוא מולקולת ה-DNA הנקראת complementary DNA או cDNA, והיא יציבה בהרבה ממולקולת ה-RNA שלפיה היא נוצרה. מולקולת ה-cDNA מסייעת למדענים לחקור תהליכים שונים בתא, כמו בקרה על ביטוי גנים, יצירת ספריות DNA למחקר עתידי ואף פיתוח תרופות.
דף עבודה לתלמיד
דף עבודה לתלמיד
מקורות מידע
- ↑ http://ib.bioninja.com.au/standard-level/topic-2-molecular-biology/27-dna-replication-transcri/central-dogma.html
- ↑ Kaushik N, Rege N, Yadav PN, Sarafianos SG, Modak MJ, Pandey VN. Biochemical analysis of catalytically crucial aspartate mutants of human immunodeficiency virus type 1 reverse transcriptase. Biochemistry. 1996 Sep 10;35(36):11536-46. PMID:8794733 doi:http://dx.doi.org/10.1021/bi960364x
- ↑ Tachedjian G, Aronson HE, de los Santos M, Seehra J, McCoy JM, Goff SP. Role of residues in the tryptophan repeat motif for HIV-1 reverse transcriptase dimerization. J Mol Biol. 2003 Feb 14;326(2):381-96. PMID:12559908
- ↑ Preston, B., Poiesz, B., & Loeb, L. (1988). Fidelity of HIV-1 Reverse Transcriptase. Science, 242(4882), 1168-1171. Retrieved from http://www.jstor.org/stable/1702640
|

